1. 引言
随着工业现代化发展进程的加快,人类社会向环境中排放了大量的废水、废气,它们含有大量的有毒污染物质如医用药物、农药、工业染料、表面活性物质和含有重金属离子的溶液等等,这些污染物给人类的健康和生存环境带来巨大的威胁和安全隐患。而且在上述这些污染物中,应用传统的处理方法很难将其完全消除和降解。废水中的很多有机化合物可以使水中的厌氧型微生物发生异变,从而产生明显的毒害作用;所以必须创造出一些其它的非生物的降解技术来除去这些有机化合物 [1]。因此,开发一种简便、有效、快捷、无害的方法来解决和治理水体污染和大气污染是当前社会一个急切需要去解决的问题。并且,社会现代化进程的发展需要消耗大量的资源和能源,据专家分析,现今传统的化石能源已经不能继续维持人类社会的长期有效的发展,传统的化石能源的过量使用是引发当前环境问题严重的万恶之源。所以,环境问题和能源问题是现阶段可持续发展战略的两大亟待解决的严重问题。
光催化技术,是一项将太阳能转化为其他能源的新兴技术,并且表现出巨大的应用前景,因此光催化技术成为了当前科学和技术研究热点之一。日本科研工作者在实验中首次发现,利用TiO2光电极上可以直接分解水来制取氢气,这表明在光激发的条件可以利用半导体材料来进行分解水制氢 [2]。在这之后,利用TiO2进行光催化反应在环境净化领域内取得了重大的突破,在光催化降解有机物上取得了非常大的进展 [3] [4]。本文利用类石墨相氮化碳作为底物,来负载金属氧化物半导体光催化剂TiO2,制备复合式光催化剂TiO2/g-C3N4,对模拟废水中染料罗丹明B (RhB)进行光催化降解,并研究其机理,极大地拓宽了半导体光催化剂的应用领域。
2. 仪器与试剂
2.1. 实验试剂
三聚氰胺(天津市科密欧化学试剂有限公司),硝酸(广州化学试剂厂),叔丁醇(上海凌峰化学试剂有限公司),EDTA-2Na (天津市百世化工有限公司),无水乙醇(上海国药集团化学试剂有限公司),亚硝酸钠(阿拉丁试剂(上海)有限公司),氮气(广州市卓正气体有限公司),罗丹明B (天津市天新精细化工厂)。
在实验过程中用到的以上实验药品的纯度均为分析纯(AR),实验过程中所用到的去离子水(一次去离子水),由本实验室的超纯水器制得。
2.2. 实验仪器
BIG SQUID S25型恒温磁力搅拌器(上海蓝凯仪器仪表有限公司),SX-2.5-10型马弗炉(上虞市道墟科析仪器厂),JA1103N型电子天平(上海浦春计量仪器有限公司),Elma S30型超声波清洗器(昆山市超声仪器有限公司),DHG-9023A型电热恒温鼓风干燥箱(上虞市沪越仪器设备厂),TGL-16C型高速离心机(上海安亭科学仪器厂),KH-50型高压水热反应釜(上海勒顿实业有限公司),60 mm玛瑙研钵(辽宁辽砚玛瑙工艺厂),150 W双端金卤灯(上海亚明照明有限公司),XPA-2型光化学反应仪(南京胥江机电厂),GWA-UN1-10C型超纯水器(北京普析通用仪器有限责任公司)。
3. 表征方法
3.1. X-射线衍射分析(XRD)
采用德国制Bruker-D8型X射线衍射仪来对所制得的样品的相态、组成和结晶度等进行测试分析。根据得到的XRD分析数据,运用布拉格方程(公式(1))来对材料的层间距等参数进行分析计算。
(1)
公式(1)中,d为晶面间距(或层间距),θ为X射线的测量角度,n为常量,λ为Cu Kα波长:0.154 nm。
3.2. 光学性质分析(UV/Vis-DRS)
采用日本日立(Hitachi)公司的UV-3010紫外-可见漫反射光谱仪;对于固态样品,选用BaSO4为空白参比物,对样品在紫外–可见区(200 nm~800 nm)的吸光强度进行了测试分析,并根据测试结果估算出样品的带隙宽度。对于液态样品,选用纯溶剂作为空白参比物,对样品在紫外–可见区(200~800 nm)的吸光强度进行了测试,并根据得到的测试结果来计算出目标降解物的降解效率。
3.3. 光化学反应仪
本实验中为对有色染料RhB的降解,使用的是简易光化学反应仪,为本实验室课题组自行设计加工组装的简易光催化反应装置,如图1所示。采用的光源为150 W的卤钨灯(草地灯),在反应器上盖着滤光片,可以过滤掉λ < 420 nm的紫外光;在反应容器外层加上冷凝水系统可以保证反应在恒温条件下进行。
3.4. 光催化降解反应的实验方法
在可见光的条件下,通过对所制样品进行光催化降解有色染料罗丹明B (RhB),作为评价所制得的样品降解目标降解物的光催化性能。在实验中,称取一定量的光催化剂和量取一定体积某一浓度的目标降解物置于光催化反应器中(催化剂和溶液的比例是2 mg/1 mL),开启磁力搅拌器,开启光源,并在一定时间间隔移取反应悬浊液,直至光催化反应结束。移取的样品通过高速离心(10,000 rpm)的过程,得到不同光照时间间隔下的目标降解物溶液样品,最后可见光分光光度计(型号722S,上海菁华科技仪器有限公司)和紫外可见分光光度计(型号UV-3010H,日本日立)对样品进行定波(554 nm)和全波长(350~750 nm)检测其对光的吸收程度。
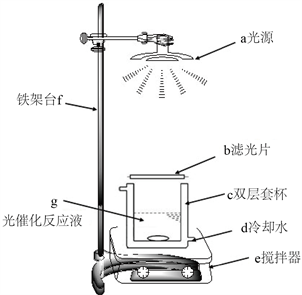
Figure 1. Halogen chemical reaction device
图1. 卤钨灯光化学反应装置
3.5. TiO2/g-C3N4复合光催化剂的制备及其性能测试
3.5.1. TiO2/g-C3N4复合光催化剂的制备
实验中所用到的试剂都是直接购买于试剂公司且在使用前未经过进一步处理。TiO2/g-C3N4复合光催化剂是利用两步反应得到;第一步是制备出g-C3N4:取一定质量的三聚氰胺(AR)研磨成粉末状后,将粉末转移到带盖的陶瓷坩埚(100 mL)中。将陶瓷坩埚放入马弗炉中,在设定其升温速率为10℃/min的加热速率下热到520℃,保持2 h后,经过1 h升温到550℃,在550℃下继续保持3 h。待陶瓷坩埚冷却至室温后关闭马弗炉,取出陶瓷坩埚中的黄色块状固体样品,将样品收集并研磨成粉末,得到的黄色粉末为所需的g-C3N4样品。
在玛瑙研钵中称取一定质量的g-C3N4粉末和TiO2混合物,加入适量的无水乙醇,搅拌研磨使之充分混合。移出至坩埚中,放入鼓风干燥箱中,使无水乙醇完全挥发。之后将坩埚放入马弗炉中,在马弗炉升温速率为10℃/min的加热速率下热到520℃,烧制2 h后取出,待坩埚冷却至室温后,将坩埚内的粉末移出备用,所得粉末即为TiO2/g-C3N4复合光催化剂样品。
3.5.2. 光催化性能测试
TiO2/g-C3N4复合光催化剂的光催化活性是通过对染料RhB的降解测评的,所使用的模拟可见光光源为150 W的双端金卤灯。实验时,将一个滤光片盖在反应容器上来过滤掉420 nm以下的紫外光从而达到可见光的环境。配置一定浓度的RhB目标降解溶液100 mL,向溶液中加入光催化剂的量为0.2 g。开动磁力搅拌器,首先进行暗吸附反应30 min使体系达到RhB的吸附–脱附平衡。之后开启光源,每隔40分钟取反应液4 mL,至反应结束。取出的含有光催化剂沉淀的反应液,经高速离心分离(10,000 rpm)后得到清液,在紫外–可见分光光度计上测定RhB的吸光度来对其降解率进行计算。
4. 分析与讨论
4.1. XRD分析
所制备的TiO2/g-C3N4复合光催化剂以及单纯的g-C3N4和TiO2的X射线衍射分析图谱如图2所示。从图2可以发现,在烧制的g-C3N4样品的谱线可以观察到在13.06˚和27.42˚处有两个明显的特征衍射峰,分别表示的是类石墨相氮化碳的层状结构中形成的氮孔的周期性排列和构成类石墨相氮化碳的基本结构——三嗪单元,两个衍射峰分别对应的是g-C3N4的(002)和(100)晶面(JCPDS no. 87-1526) [5]。对于TiO2单体,谱线在25.0˚和47.5˚处有两个明显的特征吸收峰。对于所制备的TiO2/g-C3N4复合光催化剂,其衍射峰所在的位置与TiO2单体衍射峰所在的位置基本相同,唯一不同的就是二者与g-C3N4左侧第一个峰所在处发生了极小的向上偏移。
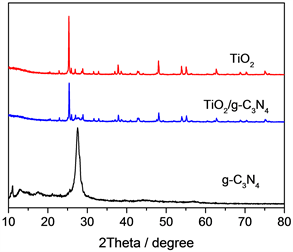
Figure 2. XRD patterns of g-C3N4, TiO2, TiO2/g-C3N4 composite photocatalyst
图2. g-C3N4,TiO2,TiO2/g-C3N4复合光催化剂的XRD谱图
4.2. DRS分析
实验中所制备的TiO2/g-C3N4复合光催化剂以及单纯的g-C3N4和TiO2的紫外可见漫反射吸收图谱见图3。从图中可见,烧制的g-C3N4样品在紫外光区(λ < 420 nm)有很强的吸收,并且它的吸收边带处于波长为453 nm处,经过计算得到g-C3N4的禁带宽度是2.69 eV,与文献报道一致 [6]。TiO2在紫外光区和可见光区都有非常良好的吸收响应,并且它的吸收边带是300~400 nm处,是良好的可见光响应材料。值得注意的是,制备的TiO2/g-C3N4复合光催化剂对光的吸收要远远的好于g-C3N4,且其吸收边带与TiO2接近。

Figure 3. TiO2/g-C3N4 composite photocatalyst and pure ultraviolet-visible diffuse absorption spectra of g-C3N4 and TiO2
图3. TiO2/g-C3N4复合光催化剂以及单纯的g-C3N4和TiO2的紫外可见漫反射吸收图
4.3. 光催化性能评价
4.3.1. 光催化降解污染物的评价方法
采用紫外可见吸收光谱法,测定了光催化反应中不同光照时间间隔的目标降解物溶液的浓度。因为在溶液浓度比较低和单色光照射的条件下,不同浓度的稀溶液对单色光的吸收遵循朗伯–比尔定律。朗伯–比尔定律为:
(2)
公式(2)中,A为溶液的吸光度,T为透过率,K为常数,c为稀溶液的浓度,b为吸收层厚度。而我们所选用的目标降解物的浓度一般是ppm (mg/L)级别的稀溶液,其符合朗伯–比尔定律,因此可以通过测量不同光照时间间隔的目标降解物的吸光度的改变量,来间接计算出不同光照时间间隔下目标降解物的浓度变化。因此可以按照公式(2)来模拟计算目标降解物的直观降解率。
降解率% =
(3)
在公式(3)中A0和C0分别表示的是光催化反应前目标降解物的吸光度和浓度;At和Ct分别表示的是t时间光催化反应后目标降解物的吸光度和浓度。

Figure 4. Photocatalytic decomposition of rhodamine B (RhB)
图4. 染料罗丹明B (RhB)的光催化分解过程
由图4可见,光催化降解染料RhB的过程分为了两步:第一个过程是RhB中的羧基发生酯化反应以及氮原子上的乙基发生脱落而被还原为氨基,将RhB分子还原为罗丹明分子。这一过程在反应开始时候2~3小时之内发生完全,现象就是溶液颜色有粉红色变为浅绿色。第二个过程是将第一步反应生成的罗丹明继续进行光催化分解,将罗丹明完全矿化为最终的产物H2O和CO2。这一过程发生在大约3小时之后,现象是颜色由浅绿色变化为无色透明。并且通过图5和图6可以发现,随着反应的进行在紫外区的吸收峰也是呈现逐步减弱的过程,证明反应过程中是发色团和环状结构同时被破坏的过程,和文献上所表述的一致 [7]。
4.3.2. 循环实验
光催化剂的循环使用能力也是评价该催化剂的光催化性能的一个重要指标,也是决定所制备的光催化剂是否具有实际应用价值的关键一环。对于TiO2半导体光催化剂,光腐蚀问题是一个难以回避的问题,采用TiO2来进行负载后我们发现可以有效地回避光催化剂的光腐蚀问题。在实验中我们对所制备的TiO2/g-C3N4样品进行了光催化循环能力的测试,发现循环使用3次之后,TiO2/g-C3N4的光催化性能没有显著的下降。在图7中可以看出,第3次循环在5小时后对染料RhB的降解依然在90%以上。通过以上实验现象可见,当g-C3N4负载TiO2后,其稳定性和循环利用性大大提高,有很大的应用前景。
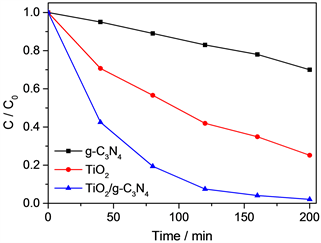
Figure 5. Degradation of dye RhB by TiO2/g-C3N4 composite
图5. 制备的TiO2/g-C3N4复合材料对染料RhB的降解实验
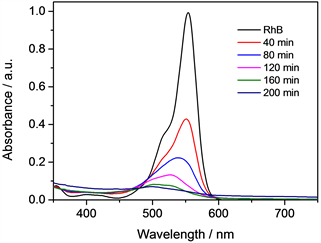
Figure 6. Ultraviolet full-wave scanning of dye RhB in degradation process
图6. 染料RhB在降解过程中紫外全波扫描图
4.3.3. 光催化机理
为了研究光催化反应的反应机理,对光催化反应体系中进行了活性物种的捕获实验。催化反应中常见的活性物种主要有羟基自由基(·OH),超氧自由基(
)和光生空穴(h+)。在本实验中,利用异丙醇(IPA)来对羟基自由基进行捕获,利用乙二胺四乙酸二钠(EDTA-2Na)来对光生空穴进行捕获以及利用N2来排除体系中的溶解氧气,达到对超氧自由基的捕获效果 [8]。通过图8我们可以发现,再加入IPA后,TiO2/g-C3N4对染料RhB的降解呈现了不明显的下降趋势,说明羟基自由基在本体系中对RhB的降解不是主要的活性物种。在通入N2后我们发现在反应初期对染料RhB的降解起到了明显的抑制作用,并且在200分钟反应结束后只发生了脱乙基的反应,而并没有发生发色团和苯环结构的破坏反应,这说明超氧自由基在本体系中起到一部分作用。而与之相对的是在体系中加入EDTA-2Na后,TiO2/g-C3N4对染料RhB的降解大为减弱,在200分钟后其降解效率下降到67%,证明在本体系中,光生空穴是染料RhB降解的主要活性物种。

Figure 8. Experimental study on photogenerated trapping in RhB experiments with visible light degradation
图8. 可见光降解RhB实验中的光生载流子捕获实验图

Figure 9. TiO2 and g-C3N4, and the photocatalytic mechanism of the composites
图9. TiO2和g-C3N4的能带位置以及复合材料的光催化机理图
综上所述,TiO2/g-C3N4样品的比表面积和晶型结构只可以改变光催化剂对染料RhB的吸附能力,他们并不是影响TiO2/g-C3N4光催化降解染料RhB的主要因素。在本实验中影响光催化性能最主要的因素是TiO2和g-C3N4的协同作用,即在两种催化剂成分之间高效的光生电子–光生空穴分离效率。
通过计算得到的TiO2和g-C3N4的能带和价、导带位置的数据,可以推断出TiO2/g-C3N4样品在参与光催化反应中光生电子和光生空穴的转移方式以及每种活性物种在体系中所起到的作用。制得的TiO2/g-C3N4样品中TiO2和g-C3N4的导带(CB)和价带(VB)的电位相对位置见图9。g-C3N4导带的电势位置比的TiO2更负,而TiO2价带的电势位置则比g-C3N4更正,因此两种半导体材料的能带是匹配的 [9]。当利用可见光对所制得的TiO2/g-C3N4光催化剂进行光照激发后,TiO2和g-C3N4同时被可见光激发,他们价带上的电子吸收光能而被激发,电子可以跃迁到其导带上,而空穴仍然留在他们的价带上。由于TiO2与g-C3N4的能带匹配,g-C3N4导带上的电子会转移到TiO2的导带上,同理TiO2价带上的空穴也会转移到g-C3N4的价带上,这样就使两种材料的光生电子与光生空穴得到有效的分离,达到了增强光催化剂光催化活性的目的 [10]。
5. 总结
本实验采用混合煅烧法制备了TiO2与g-C3N4的复合光催化剂,并研究了所制备的催化剂在光催化降解RhB中的应用。所制得的TiO2/g-C3N4复合光催化剂的光催化性能相对于两种单体,在可见光条件下对RhB的降解得到了极大的提高。在规定反应时间内可以将RhB几乎完全降解。TiO2与g-C3N4的协同作用提高了光催化活性。通过对实验中活性物种的捕获,证明光生空穴和超氧自由基是染料RhB分解的主要活性物种。经过光催化降解RhB的循环实验发现,TiO2/g-C3N4复合光催化剂可以循环使用3次,且降解率只有略微的下降,这个发现极大地拓宽了TiO2/g-C3N4复合光催化剂的应用范围。
致谢
本论文着重感谢锦州医科大学2020年大学生创新创业训练项目——抗生素/有机染料在污水中的光催化降解与氧化(项目号:202010160139)的支持与帮助。
NOTES
*通讯作者。