1. 研究背景
1.1. 核苷类似物在抗肿瘤方面的应用
在日常生活中,癌症让所有人胆战心惊。根据世界卫生组织国际癌症研究机构(IARC)统计,2020年,全世界新增癌症病例1929万例,死亡病例996万例。而我国的情况也不容乐观:2020年新增癌症病例457万例,死亡病例300万例,占全球发病率的23.7% [1]。恶性肿瘤已成为本世纪人类的第一杀手,对人类生存构成了严重的威胁,也对人类的生活造成了巨大的负担 [2]。
恶性肿瘤的预防和治疗是医学领域防治的主题。抗肿瘤药物最显著的特征是种类繁多,在作用机制及临床应用中具有很强的针对性和差异性。大多数抗肿瘤药的作用机制是阻止脱氧核糖核酸(DNA)、核糖核酸(RNA)或蛋白质的合成,或直接作用于大分子,从而抑制肿瘤细胞的分裂和增殖,使之死亡 [3]。随着科研人员对核苷类药物抗肿瘤作用机理研究的不断深入,其研究也取得了巨大进展 [4]。
核苷是一类特别重要的生物大分子,由于其结构和核酸构成相似,在抗癌新药的研究中显示出巨大的优势,特别是碱基的结构,对核苷酸类似物的生物活性起着决定性的作用,通过修饰嘧啶而得到的核苷酸类似物,其主要作用机制是通过特异性干扰DNA在肿瘤细胞中的合成、影响RNA的转录过程或者蛋白质合成,或作用于生物大分子,然后遏制肿瘤细胞的生长,使之死亡 [4] [5] [6]。
美国药理学家Gertrude Belle Elion合成了抗疱疹病毒药物–阿昔洛韦(Aciclovir),在1988年得到了诺贝尔生理学奖和医学奖。被很多知名的相关研究人员所关注,经过持续不断地深入研究,发现了十分多的修饰后的核苷类似药物。比如说,司他夫定(D4T)与恩曲他滨(NRTIs)等药物 [7]。
1.2. 5-取代核苷类似物的研究
在核苷衍生物的生物活性中,5-取代胸苷类似物已被广泛应用于临床作为抗肿瘤和抗病毒药物,例如5-碘脱氧尿苷(IdU)、5-溴脱氧尿苷(BrdU)和5-氟脱氧尿苷(FdU) [8]。研究表明,在尿嘧啶碱基5-位上引入吸电子基团、强极性基团或不饱和基团且这些基团与碱基杂环共轭时,所得衍生物往往具有较好的生物活性 [9]。5位可作为引入官能团的理想修饰位点,通过不同官能团取代后,可能具有抗肿瘤和抗病毒活性 [10] [11] [12]。
调查显示,在美国国家癌症中心所准许的抗癌先导化合物中,有五分之一的分子包含Cl、Br和I,通过对嘧啶环、嘌呤环和核糖的修饰,卤素使核酸衍生物表现出更强的抗病毒、抗代谢作用,抗菌等特性,这表明卤素在药物研发中起着重要的作用 [13]。
如5-碘-2'-脱氧尿苷(碘苷),从1962年开始就用于牛痘病毒、单纯疱疹病毒的治疗 [14]。还有一线抗癌药物5-氟尿嘧啶(Fluorouracil, 5-FU),已经作为抗肿瘤代谢药物广泛用于临床,常用于治疗肝癌,头颈部癌症、结肠癌等。
Federico等以NIS (N-碘代琥珀酰亚胺)为碘化试剂,在DMF (N,N-二甲基甲酰胺)中微波加热3分钟,完成对嘧啶环5位的碘代反应。Ganguly等采用NBS (N-溴代琥珀酰亚胺)作为溴代试剂,在n-Bu4NBr (TBAB,四丁基溴化铵)中微波加热4分钟,完成了对嘧啶环5位的溴代反应,产率达到90%以上 [15]。
1.3. 研究意义
当今世界,肿瘤是一种难以治疗的疾病。在抗癌药的市场中,核苷类药物占有不小的比重并且发挥着非常重要的作用,并且发展迅速。而由核苷类药物衍生出的类似物也被证实具有很大的抗肿瘤潜力。但近些年来,核苷类药物仍旧存有大量的问题,如不良反应多、代谢快等。因此,扩展研究核苷类似物具有重要意义。
基于硫代碱基的特点,徐耀忠与Peter Kann博士提出了“近紫外光/4-硫胸苷(UVA/Thiothymidine)光动力疗法” [16],可定向的杀死肿瘤细胞,对非肿瘤细胞的伤害轻微,缓解了肿瘤患者在治疗中的疼痛,为恶性肿瘤的治疗提供了一个新的方法 [17]。有研究显示:4-硫-5-碘脱氧尿苷345 nm处有最大吸收并且可以消灭口腔癌细胞;同样4-硫-5-溴脱氧尿苷在340 nm处有最大吸收并且可以消灭肺癌细胞。有研究成果显示在4位和5位都有取代的5-取代胸苷类似物,能够进入到细胞的DNA中,使细胞对近紫外光敏感然后死亡。此重大发现阐明了其余的双修饰核苷(如5-取代-4-硫胸苷类似物)可能会具有进入细胞的本领,让细胞更加容易受到近紫外光伤害致死 [18]。
本文探索4-硫-5-氯尿苷的合成方法,为此类化合物的合成提供了一种简便易行的方法。对于开发多功能新药具有一定的理论意义及潜在的研究价值,为抗肿瘤药物的研究奠定一定的理论基础。
2. 研究内容与方法
2.1. 实验仪器与试剂
如下表1、表2所示。
2.2. 实验路线的设计
在设计合成4-硫-5-氯尿苷路线时,硫代步骤尤为重要,该步骤往往产率较低,反应条件较苛刻,也是整个反应的重点和难点,因此分别使用五硫化二磷和劳森试剂作为硫代试剂。探索劳森试剂的最优反应条件(反应温度,试剂使用量以及反应时间),并对比在其最优条件下的反应产率,设计路线如下图1所示。
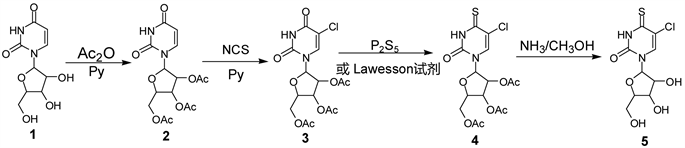
Figure 1. Synthesis route of 4-thio-5-chlorouridine
图1. 4-硫-5-氯尿苷的合成路线
2.3. 具体合成步骤
2.3.1. 2',3',5'-O-三乙酰基尿苷的合成
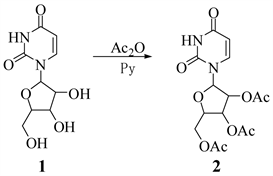
Figure 2. Synthesis of 2',3',5'-O-three acetyl uridine
图2. 2',3',5'-O-三乙酰基尿苷的合成
将尿苷(1) (2.00 g, 8.20 mmol),溶于30 mL的无水吡啶中,搅拌使其充分溶解,加入乙酸酐(6.0 mL, 64 mmol),0℃冰浴条件下持续搅拌,通过TLC监测反应情况。约5 h,原料点消失。证明反应完全,减压75℃条件下蒸出溶剂(可用甲苯共沸带出吡啶)。取出粘稠状液体,使用无水乙醇重结晶,放入冰箱过夜,有大量白色晶体析出,抽滤干燥后得到大量白色固体,即2',3',5'-O-三乙酰基尿苷(2) 2.79 g,收率为92% (路线如图2所示)。
m. p. 126℃~129℃. 1HNMR (500 MHz, DMSO-d6) δ 11.48 (s, 1H, -NH), 7.72 (d, J = 8.0 Hz, 1H, 6-H), 5.89 (d, J = 4.9 Hz, 1H, 1'-H), 5.73 (d, J = 7.9 Hz, 1H, 5-H), 5.45 (t, J = 5.5 Hz, 1H, 2'-H), 5.32 (t, J = 5.5 Hz, 1H, 3'-H), 4.25 (m, 3H, 4'-H, 5'-H), 2.07 (d, J = 12.7 Hz, 9H, 3 × -CH3).
2.3.2. 5-氯-2′,3′,5′-O-三乙酰基尿苷的合成
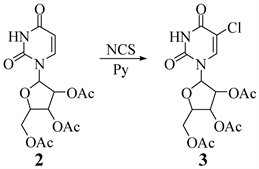
Figure 3. The synthesis of chlorine-2',3',5'-O-three acetyl uridine
图3. 5-氯-2',3',5'-O-三乙酰基尿苷的合成
将2',3',5'-O-三乙酰基尿苷(2) (1.00 g, 2.70 mmol),溶于40 mL的无水吡啶中,加热至85℃,搅拌使其充分溶解,随后加入NCS (0.55 g, 4.12 mmol),通过TLC监测反应情况。约2 h原料点消失,证明反应完全。减压75℃条件下蒸出溶剂(可用甲苯带出吡啶)。粗产品进行柱分离(PE:EA = 4:1; 3:1),再用无水乙醇和石油醚混合重结晶,抽滤干燥后得固体5-氯-2',3',5'-O-三乙酰基尿苷(3) 0.83 g,收率为76% (路线如图3所示)。
m. p. 50℃~52℃. 1HNMR (500 MHz, DMSO-d6) δ 12.02 (s, 1H, -NH), 8.16 (s, 1H, 6-H), 5.89 (d, J = 4.7 Hz, 1H, 1'-H), 5.48 (t, J = 5.4 Hz, 1H, 2'-H), 5.35 (d, J = 5.1 Hz, 1H, 3'-H), 4.35 (d, J = 8.8 Hz, 1H, 4'-H), 4.25 (m, 2H, 5'-H, 5'-H), 2.07 (d, J = 3.9 Hz, 9H, 3 × -CH3).
2.3.3. 4-硫-5-氯-2',3',5'-O-三乙酰基尿苷的合成
方法一:五硫化二磷法

Figure 4. The synthesis of 4-thio-5-chlorine-2',3',5'-O-three acetyl uridine (Route of P2S5)
图4. 4-硫-5-氯-2',3',5'-O-三乙酰基尿苷的合成(五硫化二磷法)
取5-氯-2',3',5'-O-三乙酰基尿苷(3) (1.05 g, 2.60 mmol)放入三口烧瓶中,加入无水1,4-二氧六环55 mL至全部溶解,加入五硫化二磷(1.13 g, 5.09 mmol),升温至105℃,通过TLC监测反应情况,6 h反应完全,冷却过滤蒸干溶剂,柱分离(PE:EA = 4:1; 3:1; 2:1)得到黄色固体4-硫-5-氯-2',3',5'-O-三乙酰基尿苷(4) 0.47 g,收率为43% (路线如图4所示)。
方法二:劳森试剂法
首先,筛选劳森试剂反应的最优条件,参考五硫化二磷反应条件再将其扩大范围,反应温度设计为85℃、90℃、95℃、100℃、105℃、110℃,反应底物与试剂用量的比值设计为1:0.5、1:1、1:1.5、1:2,反应时间设计为2 h、3 h、3.5 h、4 h、5 h、6 h。具体实验过程如下:
取5-氯-2',3',5'-O-三乙酰基尿苷(3) (1.05 g, 2.60 mmol)放入三口烧瓶中,加入无水1,4-二氧六环55 mL至全部溶解,加入劳森试剂(1.10 g, 2.73 mmol),升温至95℃,通过TLC监测反应情况,柱分离(PE:EA = 3:1)得到黄色固体4-硫-5-氯-2',3',5'-O-三乙酰基尿苷(4) (路线如图5所示)。

Figure 5. The synthesis of 4-thio-5-chlorine-2',3',5'-O-three acetyl Uridine (Route of Lawesson reagent)
图5. 4-硫-5-氯-2',3',5'-O-三乙酰基尿苷的合成(劳森试剂法)
m. p. 48℃~50℃. 1HNMR (500 MHz, DMSO-d6) δ 13.16 (s, 1H, NH), 8.28 (s, 1H, 6-H), 5.85 (d, 1H, J = 5.86 Hz, 1'-H), 5.48 (s, 1H, J = 5.53 Hz, 2'-H), 5.35 (t, 1H, 3'-H), 4.35 (m, 3H, 4'-H, 5'-H), 2.06 (m, 9H, 3 × -CH3).
2.4. 4-硫-5-氯尿苷的合成
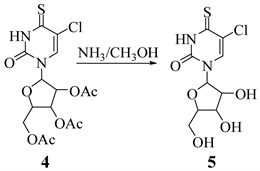
Figure 6. The synthesis of 4-thio-5-chlorine uridine
图6. 4-硫-5-氯尿苷的合成
取黄色固体4-硫-5-氯-2',3',5'-O-三乙酰基尿苷(4) (0.50 g, 1.19 mmol),用饱和氨气甲醇溶液100 mL,室温搅拌至完全溶解。通过TLC监测反应情况,约6 h停止反应。减压条件下除去溶剂,柱分离(CHCl2:CH3OH = 20:1),得到黄色固体4-硫-5-氯尿苷(5) 0.16 g,收率为46% (路线如图6所示)。
m. p.54℃~57℃。
1HNMR (500 MHz, DMSO-d6) δ 13.12 (s, 1H, -NH), 8.57 (s, 1H, 6-H), 5.68 (d, J = 3.2 Hz, 1H, 1'-H), 5.52 (d, J = 5.0 Hz, 1H, 2'-OH), 5.35 (t, J = 4.3 Hz, 1H, 3'-OH), 5.08 (d, J = 5.9 Hz, 1H, 5'-OH), 4.08 (m, 1H, 2'-H), 4.01 (d, J = 5.1 Hz, 1H, 3'-H), 3.89 (d, J = 2.8 Hz, 1H, 4'-H), 3.74 (m, 1H, 5'-H), 3.60 (m, 1H, 5'-H).
13CNMR (125 MHz, DMSO-d6) δ 185.36 (4-C), 147.07(2-C), 134.71 (6-C), 116.81 (5-C), 89.36 (1'-C), 84.57 (4'-C), 74.13 (2'-C), 68.72 (3'-C), 59.63 (5'-C).
3. 结果与讨论
通过两种不同的方法成功合成了4-硫-5-氯尿苷及3种最终硫代产物,并通过实验发现劳森试剂法的最优反应条件是:温度95℃,与底物的比值为1:1,反应时间3.5 h (具体数据见下表3~5)。与五硫化二磷法比较,其具有反应条件温和、时间更短,收率更高的特点。最终产物通过1HNMR和13CNMR进行了表征。这将有利于该类化合物作为药物的前期研究提供了方向和理论基础。

Table 3. The relation between the temperature and the reaction yield of Lawesson reagent in the synthesis of 4-thio-5-chlorine uridine
表3. 劳森试剂法在4-硫-5-氯尿苷的合成中反应温度与收率的关系

Table 4. The relation between the quantity and the reaction yield of Lawesson reagent in the synthesis of 4-thio-5-chlorine uridine
表4. 劳森试剂法在4-硫-5-氯尿苷的合成中试剂量与收率的关系

Table 5. The relation between the time and the reaction yield of Lawesson reagent in the synthesis of 4-thio-5-chlorine uridine
表5. 劳森试剂法在4-硫-5-氯尿苷的合成中反应时间与收率的关系
基金项目
克拉玛依市创新环境建设(创新人才)项目(2020CXRC0061)资助。
NOTES
*通讯作者。