1. 引言
钝缀锦蛤(Tapes dorsatus Lamarck, 1818)隶属瓣鳃纲(Lamellibranchia)、帘蛤目(Veneroida)、帘蛤科(Veneridae)、缀锦蛤属(Tapes),是一种大型热带、亚热带海洋经济贝类,主要分布在西南太平洋海域,在我国主要分布在东海、南海和台湾海峡 [1]。钝缀锦蛤主要栖息在潮间带中、低潮区至潮下带及浅海的泥沙底质中,营埋栖生活,具有生长速度快、营养价值高和味道鲜美等优点 [2] [3]。目前,有关钝缀锦蛤的研究和报道集中在形态 [4] [5] [6]、生态习性 [2] [7] [8]、进化地位 [9] [10] 和繁殖生物学 [3] [11] [12] 等方面,免疫相关基因表达规律方面尚未见报道。
我国水产动物养殖因病害造成的经济损失可达20~30亿元/年,细菌性感染是主要原因 [13] [14]。已有研究报道细菌性疾病造成长牡蛎(Crasso streagigas) [15]、菲律宾蛤仔(Ruditapes philippinarum) [16] 和长竹蛏(Solenstrictus) [17] 等水产动物大量死亡。本课题组前期实验从广西北海市人工养殖的钝缀锦蛤体内分离获得多种细菌,16S rRNA鉴定结果表明,溶藻弧菌在所有菌属中的占比最高。海洋贝类属于低等的无脊椎动物,免疫防御系统主要依赖于多种分子参与的非特异性免疫应答,该应答反应具有反应速度快和作用相对稳定的特点。
Chawsheen等 [18] 研究表明,包括硫氧还蛋白5 (TXNDC5)在内的硫氧还蛋白家族成员可参与细胞炎症反应。TXNDC5,又称ERp46,是蛋白二硫化物异构酶(Protein disulfide isomerase family, PDI)中的一员,同属硫氧还蛋白(Thioredoxin, TRX)家族 [19],具有依赖于半胱氨酸残基进行氧化还原反应的活性位点 [20]。TXNDC5在炎症反应 [18]、蛋白质正确折叠 [21]、氧化还原调节 [22]、抗氧化应激 [23]、蛋白二硫键重排和凋亡阻滞 [22] [24] 等生命过程中具有重要作用。研究表明,TXNDC5基因在类风湿性关节炎患者的滑膜成纤维细胞 [25]、肺纤维化疾病的组织 [26] 以及癌症患者的组织和细胞 [18] [27] 中高表达。水产动物TXNDC5基因的研究相对较少,仅有Sandamalik等 [28] 和Liyanage等 [29] 分别报道了大肚海马(Hippocampus abdominalis)和盘鲍(Haliotis discus)的TXNDC5基因特征和表达规律。
目前,瓣鳃纲贝类的TXNDC5基因在细菌胁迫下的表达规律尚未见报道。本实验旨在研究钝缀锦蛤TXNDC5 (TdTXNDC5)基因的序列特征及响应溶藻弧菌(Vibrio alginolyticus)胁迫的表达规律,通过人工注射法向钝缀锦蛤的前闭壳肌注射溶藻弧菌溶液,检测注射后不同时间点钝缀锦蛤的鳃、外套膜、消化盲囊和内脏团中TdTXNDC5基因的表达量的变化情况,为探究TdTXNDC5基因在钝缀锦蛤体内的免疫机理提供参考,为海洋贝类细菌性疾病的防治提供理论依据。
2. 材料与方法
2.1. 实验材料
2021年10月5日在广西北海市南珠市场购买150只无外伤的钝缀锦蛤(壳长6.38 cm ± 0.58 cm,体质量43.40 g ± 5.04 g),置于海水运至北部湾大学海洋学院养殖室,在养殖箱(45 cm × 30 cm × 30 cm)暂养,每箱15只。海水高度20 cm,盐度25~27,水温25℃~28℃,溶解氧 > 5.0 mg/L。暂养7 d,期间采用自然光照,每天投喂亚心形扁藻(Platymonas subcordiformis)溶液1次,每次1 L。
2.2. 组织RNA提取和cDNA文库构建
参考Lu等 [30] 方法,暂养结束后,从养殖箱随机捞取3只钝缀锦蛤置于冰上麻醉,取75%酒精棉球擦拭贝壳,用无菌解剖工具依次剪取钝缀锦蛤的心脏、鳃、斧足、外套膜、出水管、闭壳肌、消化盲囊和内脏团等8种组织到匀浆管,加入RNAiso Plus溶液匀浆破碎。根据RNAiso Plus试剂说明书(TaKaRa)分别提取上述8种组织的总RNA,参照PrimeScript RT reagent Kit说明书(TaKaRa)合成cDNA第一链,产物置于−80℃保存。根据本课题组已测序的钝缀锦蛤基因组信息数据库查找TdTXNDC5基因序列的上、下游非编码区序列信息,利用Oligo 6.0软件设计克隆引物和定量引物(表1),并委托公司(上海生工)合成。

Table 1. The primers used in this paper
表1. 本文所用引物
2.3. TdTXNDC5基因克隆、测序和生物信息学分析
参考朱鹏等 [31] 实验方法,以步骤1.2反转录所得cDNA为模板,参照TksGflex Polymerase试剂说明书(TaKaRa)扩增TdTXNDC5基因的开放阅读框(Open Reading Frame, ORF)序列。PCR反应体系为:2× Buffer 12.5 μL,上、下游引物(浓度为10 μmoL/L)各1 μL,Tks酶0.5 μL,cDNA模板1 μL,补加超纯水至25 μL。反应程序为:94℃ 4 min;94℃ 30 s,65℃ 30 s,72℃ 60 s (5个循环);94℃ 30 s,63℃ 30 s,72℃ 60 s (5个循环);94℃ 30 s,61℃ 30 s,72℃ 60 s (20个循环);72℃延伸10 min。克隆产物连接到Peasy-Blunt Simple载体(北京全式金)获得重组载体,将重组载体导入Trans1-T1感受态细胞(北京全式金),阳性克隆菌株送至公司(上海生工)测序。测序结果利用SeqMan软件拼接,用TBtools软件预测完整的ORF序列。
用EXPASY服务器解析TXNDC5蛋白的分子式、分子大小、各种氨基酸占比及等电点(pI)等信息。用Softberry在线软件预测该蛋白质的亚细胞定位,SignIP软件预测TXNDC5蛋白的信号肽,DNAStar的Protean程序预测蛋白质二级结构。利用MEGA 7.0软件根据TXNDC5蛋白的氨基酸序列构建系统发育树(Bootstraps设为1000)。
2.4. 钝缀锦蛤人工感染及实时荧光定量PCR
根据预实验结果得知,溶藻弧菌(V. alginolyticus)对钝缀锦蛤的半致死浓度(LC50)为1.0 × 108 CFU/50 g,因此在该浓度进行人工感染实验。本实验随机挑选90只钝缀锦蛤,平均分成两组(每组45只),将45只钝缀锦蛤分到3个养殖箱中,每箱15只。用一次性注射器向钝缀锦蛤的前闭壳肌注射0.1 mL溶藻弧菌溶液(1.0 × 109 CFU/mL),对照组注射等量的灭菌海水。分别在注射后的第3 h、6 h、9 h、12 h、24 h、48 h、72 h和96 h采集鳃、外套膜、消化盲囊和内脏团等组织,每个时间点取样3只,参照步骤1.2分别提取组织总RNA并反转录成cDNA。
为检测溶藻弧菌胁迫下,钝缀锦蛤不同组织中TdTXNDC5基因的表达规律,本实验采用qRT-PCR技术检测注射后不同时间点TdTXNDC5基因的相对表达量,并以EF-1α为内参基因。反应体系:2× SYBR Green PreMix Ex Taq (TaKaRa) 10 μL,cDNA模板2 μL,上、下游引物各0.3 μL,最后补加超纯水至20 μL,每个样品3个重复。反应程序:95℃ 3 min,95℃ 10 s,60℃ 30 s (39个循环),95℃ 10 s,溶解曲线:65℃~95℃ (增幅为0.5℃),5 s。钝缀锦蛤不同组织TdTXNDC5基因的相对表达量根据qRT-PCR结果的2−∆∆Ct进行计算。
2.5. 统计学分析
实时荧光定量PCR结果利用SPSS软件的ANOVA程序和Tukey’s程序分析。利用t检验对数据进行比较,统计显著性的判断标准为p < 0.05,极显著的判断标准为p < 0.01。
3. 结果与分析
3.1. TdTXNDC5基因特征分析
TdTXNDC5基因克隆产物的电泳结果见图1,分子大小为1326 bp (包含49 bp的5’非编码区和41 bp的3’非编码区),与目标分子大小一致,可用于后续测序和序列分析。测序结果用TBtools软件预测基因的ORF序列,结果表明,TdTXNDC5基因的ORF长度为1236 bp。将上述ORF序列上传至GenBank数据库(登录号:OM891503),并利用Primer Primier5.0软件预测TdTXNDC5基因对应的氨基酸序列,与数据库现有的序列进行比对。
TdTXNDC5蛋白的理化性质预测结果显示,蛋白分子中包含411个氨基酸残基,组成分子式为C2058H3197N535O643S21,含量最高的是赖氨酸(Lys)为9.0%,其次是谷氨酸(Glu)为8.5%,最低的是色氨酸(Trp)为1.2%。蛋白的等电点为5.05,理论分子量是46.40 kD。亚细胞定位和信号肽预测结果显示,TdTXNDC5蛋白主要存在于真核细胞的内质网(Endoplasm reticulum),N末端含有1段长度为20 aa的信号肽(序列为MQNFIFGCVICICLIAVVTS)。

Figure 1. Agarose gel electrophoresis of TdTXNDC5 gene
图1. TdTXNDC5基因琼脂糖凝胶电泳图
TdTXNDC5蛋白的氨基酸组成见图2,序列中包含3个典型的Cys-X-X-Cys结构(红色方框标记),分别位于氨基酸序列的N末端第8~11位、54~57位和194~197位。TdTXNDC5蛋白的内质网滞留信号(ER retention signal)位于C末端,可负责在内质网上的定位(绿色方框标记)。

Figure 2. TdTXNDC5 gene sequence and corresponding amino acid sequence
图2. TdTXNDC5基因序列及对应的氨基酸序列
TdTXNDC5蛋白的二级结构预测结果见图3,二级结构中包含17个α-螺旋、9个β-折叠、24个β-转角和19个无规则卷曲。

Figure 3. Prediction of secondary structure of TdTXNDC5 protein
图3. TdTXNDC5蛋白二级结构预测
3.2. TdTXNDC5蛋白序列同源性及进化关系分析
基于TXNDC5蛋白的氨基酸序列的多序列比对结果见图4,钝缀锦蛤TXNDC5与硬壳蛤(Mercenaria mercenaria)同源性最高,为70.77%,与美洲牡蛎(Crassostrea virginica)的同源性为37.92%,与长牡蛎的同源性为39.19%。上述结果表明,TXNDC5蛋白在不同海水贝类中具有一定的保守性,均含3个PDI结构域,分别标记为Thioredoxin结构域(红色箭头)、PDI_a_ERp46结构域(蓝色箭头)和PDI_a_ERp38结构域(绿色箭头)。

Figure 4. Comparison of multiple sequences of TdTXNDC5 protein and homologous family protein
图4. TdTXNDC5蛋白及同源家族蛋白多序列比较
基于TXNDC5氨基酸序列构建的系统发育树见图5,钝缀锦蛤TXNDC5蛋白仅与硬壳蛤聚为一支,与长牡蛎、美洲牡蛎及盘鲍等海水贝类并没有聚在一起。
3.3. TdTXNDC5基因在不同组织表达结果分析
钝缀锦蛤不同组织中TdTXNDC5基因的表达量见图6,TdTXNDC5基因在钝缀锦蛤的鳃、外套膜、心脏、斧足、出水管、内脏团、闭壳肌和消化盲囊等8种组织中均可表达。鳃组织的表达量最高,是消化盲囊表达量的8.75倍,外套膜和心脏组织的表达量仅次于鳃,分别是消化盲囊表达量的7.33倍和6.10倍。

Figure 5. Phylogenetic tree based on TXNDC5 amino acid sequence
图5. 基于TXNDC5氨基酸序列构建系统发育树
 注:横坐标不同字母代表钝缀锦蛤的组织,纵坐标为TdTXNDC5基因的相对表达量。G:鳃;M:外套膜;H:心脏;F:斧足;E:出水管;V: 内脏团;A:闭壳肌;D:消化盲囊。
注:横坐标不同字母代表钝缀锦蛤的组织,纵坐标为TdTXNDC5基因的相对表达量。G:鳃;M:外套膜;H:心脏;F:斧足;E:出水管;V: 内脏团;A:闭壳肌;D:消化盲囊。
Figure 6. Distribution of TdTXNDC5 gene in different tissues of T. dorsatus
图6. TdTXNDC5基因在钝缀锦蛤不同组织的分布
3.4. 溶藻弧菌胁迫下TdTXNDC5基因表达规律
溶藻弧菌胁迫下,TdTXNDC5基因在钝缀锦蛤不同组织的表达时序结果见图7。钝缀锦蛤鳃、外套膜、消化盲囊和内脏团等四种组织中TdTXNDC5基因的表达量总体呈现先上升后下降、再上升的趋势。鳃组织在注射后的第3 h表达量达到峰值,是对照组的3.24倍(p < 0.01)。外套膜和内脏团在注射后的第6 h表达量达到峰值,分别是对照组的18.67倍和6.02倍(p < 0.01)。消化盲囊在注射后的第48 h表达量达到峰值,是对照组的2.18倍(p < 0.01)。
4. 讨论
4.1. TXNDC5生物信息学分析
TXNDC5是最早被鉴别为TRX家族的新成员,在细胞生长、增殖、凋亡和炎症反应等多方面具有调节作用 [32]。本研究利用梯度PCR技术首次克隆获得钝缀锦蛤TXNDC5基因的ORF序列,长度为1236 bp,可编码411个氨基酸残基,理论分子量为46.40 kD。TdTXNDC5蛋白分子中含有3个典型的PDI结构域,N末端具有1段长度为20 aa的信号肽,C末端具有1个内质网滞留信号结构(399D-E-411L)。本实验结果与已报道的大肚海马 [28] 和盘鲍 [29] 等物种的TXNDC5蛋白结构和理化性质高度一致,说明TXNDC5蛋白在不同种类的海洋动物中高度保守,因此推测其在生命体内可能具有重要作用。
 (a)
(a)  (b)
(b) 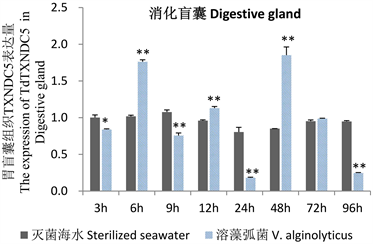 (c)
(c)  (d)
(d)
Figure 7. Changes of TdTXNDC5 gene expression in tissues of T. dorsatus under the stress of V. alginolyticus
图7. 溶藻弧菌胁迫下钝缀锦蛤组织TdTXNDC5基因表达变化
4.2. TXNDC5基因的组织表达差异性分析
目前,有关人类或其他哺乳动物TXNDC5基因的报道较多,且集中在人类或其他动物的疾病方向。Yu等 [20] 研究表明,TXNDC5基因高表达于类风湿性关节炎患者滑膜组织中;当抑制TXNDC5基因的表达后,类风湿关节炎滑膜细胞的增殖和迁移能力明显降低、凋亡率明显增加 [21]。作为内质网应激通路上的重要蛋白,Nakamura等 [23] 研究表明,TXNDC5蛋白可参与小鼠肺组织纤维化过程。Wang等 [25] 细胞实验结果表明,LPS刺激后,滑膜成纤维细胞中TXNDC5基因的表达量上调,若抑制TXNDC5基因的表达,滑膜成纤维细胞中TNFα和IL-6基因的表达量也会下降,因此猜测TXNDC5基因在NF-κB信号通路上可能具有重要作用。张永丽等 [33] 研究结果表明,沉默前列腺癌PC3细胞中的TXNDC5基因后,过氧化物还原酶2 (Prx2)基因的表达可被抑制。另外,Zeng等 [34] 研究表明,TXNDC5基因还可在脓毒性败血症患者的血浆中高表达。
本实验结果表明,TdTXNDC5基因在钝缀锦蛤的8种组织中均有表达,表达量从高到低依次是鳃、外套膜、心脏、斧足、出水管、内脏团、闭壳肌和消化盲囊,其中鳃、外套膜和心脏等免疫相关组织中的表达量分别是消化盲囊表达量的8.75倍、7.33倍和6.10倍。与本实验结果一致,Kulatunga等 [24] 研究结果表明,TXNDC5的同家族成员TXNDC12基因也是在斑马鱼(Daniorerio)的鳃组织高表达。Sandamalika等 [28] 研究结果表明,ShTXNDC5基因在大肚海马的卵巢、鳃和育儿袋中高表达,其表达量分别是肝脏表达量的46.9倍、43.5倍和12.02倍。Liyanage等 [29] 研究结果表明,AbTXNDC5基因盘鲍的消化腺和血细胞中高表达。
4.3. 胁迫下TXNDC5基因表达规律分析
溶藻弧菌胁迫下,TdTXNDC5基因在钝缀锦蛤的鳃、外套膜、消化盲囊和内脏团组织中的表达趋势一致,呈现先上升后下降、再上升的趋势,鳃的表达量在第3 h达到峰值,外套膜和内脏团在第6 h达到峰值。斑马鱼暴露于H2O2、迟缓爱德华氏菌(Edwardsiella tarda)或寄生水霉(Saprolegnia parasitica),TXNDC12基因表达量也显著上调 [24]。大肚海马在LPS、Poly (I:C)、迟缓爱德华氏菌或海豚链球菌(Streptococcus iniae)刺激下,血液和肾脏组织中ShTXNDC5基因的表达量均显著上调(p < 0.05) [28]。盘鲍在副溶血弧菌(V. parahaemolyticus)、李斯特氏菌(Listeria monocytogenes)、Poly (I:C)、LPS或出血性败血症病毒(VHSH)等外源刺激下,血细胞和鳃中AbTXNDC5基因的表达上调,且均在第12 h达到峰值(p < 0.05) [29]。
综上所述,TXNDC5基因从低等的海水贝类和硬骨鱼类,到人类及其他哺乳动物的组织和器官中均可表达,且在外源异物刺激或内源病变的组织器官中高表达。因此猜测,TXNDC5基因在机体应对外源刺激或内源病变过程中可能发挥着不可或缺的作用。本实验首次克隆了瓣鳃纲物种的TXNDC5基因,并分析了其分子结构、理化性质及溶藻弧菌胁迫下不同组织的表达规律,其分子功能和作用机制有待进一步阐明。
5. 结论
本文利用梯度PCR技术克隆获得钝缀锦蛤TXNDC5基因的ORF序列,蛋白结构预测和进化关系结果显示,TdTXNDC5蛋白分子中包含3个典型的PDI结构域,与硬壳蛤的亲缘关系最近。TdTXNDC5基因在钝缀锦蛤所有组织中均可表达,特别是在免疫相关组织中高表达。溶藻弧菌胁迫下,TdTXNDC5基因在钝缀锦蛤鳃、外套膜、消化盲囊和内脏团等四种组织中的表达量呈现先上升后下降、再上升的趋势,因此猜测其在钝缀锦蛤应答溶藻弧菌感染中可能发挥了重要功能。
基金项目
广西科技重大专项(AA19254008-3, AA19254032)、大学生创新创业项目(S202111607045)。
NOTES
*通讯作者。