1. 引言
氮杂吲哚及其衍生物是一种重要的杂环化合物,是合成维罗非尼等抗肿瘤药物的重要中间体,具有较高的生物医药价值 [1]。其作为一类新型的杂环化合物,由于其在结构上与吲哚有突出的相似性以及它的衍生物具有抑制多种蛋白酶的活性从而引起人们广泛的重视 [2]。该类杂环化合物具有特殊的理化和药理性质,在医药、农药、及食品等领域都有着广泛用途 [3]。1H-吡唑[3,4-b]并吡啶作为氮杂吲哚类的一种结构,与吲哚、嘌呤类结构相似,因此其衍生物具有潜在的生物和药用价值。
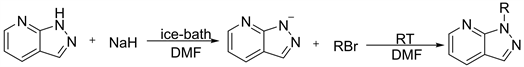
目前尚无1H-吡唑[3,4-b]并吡啶的N-H烷烃取代的报道,通过参考7-氮杂吲哚N-H取代方法,设计了一条N-烷基-1H-吡唑[3,4-b]并吡啶的合成路线,并对其合成条件进行优化。对7-氮杂吲哚N-H取代衍的合成方法的报道 [4] [5] [6] [7] 通常以氢化钠为脱H试剂,四氢呋喃或N,N-二甲基甲酰胺作为溶剂,在高温等条件下进行,产率一般,且从实验条件及反应时间看来,并不太理想。本文以1H-吡唑[3,4-b]并吡啶为起始原料,与卤代烃进行取代反应,制备N-烷基-1H-吡唑[3,4-b]并吡啶,实验以1H-吡唑[3,4-b]并吡啶为起始原料,N,N-二甲基甲酰胺为溶剂,4-二甲氨基吡啶做催化剂,冰浴条件下以氢化钠为脱氢试剂30 min,室温条件下加入不同的溴代烷烃进行取代30 min,在惰性气体保护下进行。该方法一定程度上缩短了反应时间,减少能源消耗,降低操作危险,提高反应产率。成功合成的五种化合物,具体合成路线如图1所示。
 table_table_table_4-3070158_1_hanspub.htm
table_table_table_4-3070158_1_hanspub.htm
Figure 1. Synthesis of N-Alkyl-1H-pyrazolo[3,4-b]pyridine
图1. N-烷基-1H-吡唑[3,4-b]并吡啶合成
2. 实验
2.1. 仪器与试剂
DF-101T集热式恒温加热磁力搅拌器(上海梅颖浦仪器仪表制造有限公司);RE-2000A旋转蒸发器(郑州特尔仪器设备有限公司);ZF-C三用紫外分析仪(上海沪西分析仪器厂有限公司);SHB-III循环水式多用真空泵(郑州长城科工贸有限公司);LE204E电子天平(梅特勒-托利多仪器有限公司);Axima CFR plus 型飞行时间质谱仪(日本岛津公司);Bruker ACF-300型核磁共振仪(TMS为内标,德国布鲁克公司)。
1H-吡唑[3,4-b]并吡啶(98%,安徽泽升科技有限公司);7-氮杂吲哚(98%,乐研新生物科技有限公司);氢化钠(60%,上海麦克林生化科技有限公司);4-二甲氨基吡啶(99%,上海麦克林生化科技有限公司);乙酸乙酯(分析纯,上海麦克林生化科技有限公司)、石油醚(分析纯,上海麦克林生化科技有限公司)、N,N-二甲基甲酰胺(分析纯,上海麦克林生化科技有限公司)。
2.2. 化合物a-e的合成通法
该反应以1H-吡唑并[3,4-b]吡啶为原料,与一系列溴代烷烃进行取代如图2所示。
将1.19 g (10 mmol)1H-吡唑[3,4-b]并吡啶溶于50 ml N,N-二甲基甲酰胺中,加入0.12 g (1 mmol) 4-二甲氨基吡啶,冰浴使反应体系降至0℃~5℃,N2保护下缓慢加入0.26 g (11 mmol) NaH,此温度下反应0.5 h后,缓慢滴加11 mmol溴代烷烃,滴加完毕,升至室温搅拌0.5 h。反应完毕,冰水淬灭,加入乙酸乙酯萃取(50 mL × 3),合并有机相,用5% K2HCO3溶液洗涤(50 ml × 2),经无水硫酸镁干燥后过滤,滤液减压蒸除溶剂,得目标产物。
在上述条件基础之上,以1.19 g (10 mmol) 1H-吡唑[3,4-b]并吡啶为基础原料,溶于50 ml N,N-二甲基甲酰胺中,加入10% mmol 4-二甲氨基吡啶,进行脱氢处理后分别于与溴乙烷,溴代环丙烷,溴代环丁烷,溴代环戊烷,溴化苄在室温条件下进行取代,粗产品经过冰水淬灭,乙酸乙酯萃取,5% K2HCO3溶液洗涤,无水硫酸镁干燥,浓缩后得产物a-e。
2.3. 化合物的结构表征
表征数据
乙基-1H-吡唑并[3,4-b]吡啶(a):黄色油状液体,产率94.4%。1HNMR (500 MHz, DMSO-d6) δ: 8.55 (dd, J = 4.5, 1.6 Hz, 1 H,), 8.23 (dd, J = 8.0, 1.6 Hz, 1 H,), 8.15 (s, 1H,), 7.21 (dd, J = 8.0, 4.4 Hz, 1H,), 4.50 (q, J = 7.2 Hz, 2H,), 1.42 (t, J = 7.2 Hz, 3 H,); 13CNMR (500 MHz, DMSO) δ: 149.71, 148.97, 132.28, 130.83, 117.24, 115.54, 41.83, 15.22.GC-MS, m/z: 147.08 [M + H]+.
1-环丙基-1H-吡唑并[3,4-b]吡啶(b):淡黄色油状液体,产率93.2%。1HNMR (500 MHz, DMSO-d6) δ: 8.53 (dd, J = 4.5, 1.6 Hz, 1 H), 8.25 (dd, J = 8.0, 1.6 Hz, 1 H), 8.16 (s, 1H), 7.20 (dd, J = 8.0, 4.5 Hz, 1 H), 2.42 (p, J = 7.0 Hz, 1 H), 0.84~0.73 (m, 2 H), 0.54 (tt, J = 7.1, 4.3 Hz, 2 H); 13CNMR (500 MHz, DMSO) δ: 162.77, 152.14, 149.14, 133.62, 130.44, 117.14, 114.85, 36.23, 31.23. GC-MS, m/z: 159.08 [M + H]+.
1-环丁基-1H-吡唑并[3, 4-b]吡啶(c):黄白色油状液体,产率92.5%。1HNMR (500 MHz, DMSO-d6) δ: 8.55 (dd, J = 4.5, 1.6 Hz, 1 H), 8.25 (dd, J = 8.0, 1.6 Hz, 1 H), 8.21 (s, 1 H), 7.23 (dd, J = 8.0, 4.5 Hz, 1 H), 5.50 (p, J = 8.4 Hz, 1 H), 2.72 (dddd, J = 19.0, 10.1, 9.0, 2.7 Hz, 2 H), 2.49~2.39 (m, 2 H), 1.90 (tt, J = 10.7, 6.2 Hz, 2 H); 13CNMR (500 MHz, DMSO) δ: 149.69, 148.93, 132.62, 130.93, 117.52, 115.81, 50.38, 30.04 (2C), 14.92. GC-MS, m/z: 173.10 [M + H]+.
1-环戊基-1H-吡唑并[3, 4-b]吡啶(d):白色油状液体,产率92.1%。1HNMR (500 MHz, DMSO-d6) δ: 8.55 (dd, J = 4.5, 1.6 Hz, 1 H), 8.24 (dd, J = 8.0, 1.6 Hz, 1 H), 8.16 (s, 1 H), 7.22 (dd, J = 8.0, 4.5 Hz, 1 H), 5.47~5.34 (m, 1 H), 2.19~2.08 (m, 2 H), 2.08~1.99 (m, 2 H), 1.96~1.85 (m, 2 H), 1.72 (dtd, J = 11.6, 7.4, 7.0, 3.4 Hz, 2H). 13CNMR (500 MHz, DMSO) δ: 149.87, 148.79, 132.17, 130.81, 117.31, 115.72, 57.22, 32.39 (2C), 24.72 (2C). GC-MS, m/z: 187.11 [M + H]+.
1-苄基-1H-吡唑并[3, 4-b]吡啶:红色油状液体(e),产率92.2%。1HNMR (500 MHz, DMSO-d6) δ 8.59 (dd, J = 4.5, 1.6 Hz, 1 H), 8.28 (dd, J = 8.0, 1.6 Hz, 1 H), 8.21 (s, 1 H), 7.35~7.21 (m, 6 H), 5.70 (s, 2 H); 13CNMR (500 MHz, DMSO) δ: 150.22, 149.41, 137.97, 133.06, 131.07, 128.97, 127.94, 117.57, 115.60, 50.39. GC-MS, m/z: 209.10 [M +H]+.
表征仪器
Axima CFR plus型飞行时间质谱仪(日本岛津公司);Bruker ACF-300型核磁共振仪(TMS为内标,德国布鲁克公司)。
3. 结果与讨论
3.1. 反应条件的优化
本研究首先以1H-吡唑[3,4-b]并吡啶与溴乙烷的亲核取代为模型反应,探索了该反应的反应条件,根据以上实验通法,1H-吡唑[3,4-b]并吡啶为原料,N,N-二甲基甲酰胺为溶剂,冰浴条件下脱-H,室温条件下与溴代烷反应,浓缩的黄色油状液体。对影响其收率的因素包括溶剂、反应时间、反应温度、是否有催化剂、是否有氧等几个方面进行讨论,实现总收率90%~94%。
3.1.1. 溶剂对产率的影响
以化合物1H-吡唑[3,4-b]并吡啶为研究底物,考察了N,N-二甲基甲酰胺、乙腈、四氢呋喃、二氯甲烷、四种溶剂对产率的影响(表1),结果表明,以N,N-二甲基甲酰胺为溶剂时取得产率较高。

Table 1. The effect of different solvents on the yield
表1. 不同溶剂对产率的影响
3.1.2. 反应时间对产率的影响
基于以上条件优化,以N,N-二甲基甲酰胺为溶剂,冰浴条件下脱H 30 min,考察第二步反应时间对实验产率的影响(表2)。结果表明,将第二步反应时间控制在30 min产率较高,时间过短反应不完全,时间过久,产率不再提高,且有产生副产物的风险。

Table 2. Effect of reaction time on yield
表2. 反应时间对产率的影响
3.1.3. 反应温度对产率的影响
以N,N-二甲基甲酰胺为溶剂,冰浴条件下脱H 30 min,考察第二步反应温度对实验产率影响(表3),结构表明,温度控制在25℃进行取代时目标产物产率较高,冰浴条件下虽然产率同样较高,但操作条件相对复杂,温度较高产率不会增加。

Table 3. Product yields at different temperatures
表3. 不同温度下产物产率
3.1.4. 催化剂和是否氮气保护对产率影响
基于以上优化条件,研究催化剂和氧气条件对实验产率的影响(表4)。结果表明,在加入10% mmol 4-二甲氨基吡啶以及氮气保护条件下进行时产率较高。

Table 4. Oxygen conditions and the effect of catalyst addition on product yield
表4. 氧气条件与是否加入催化剂对产物产率影响
3.2. 反应底物的拓展
在优化条件的基础上,进一步探索了取代基和反应底物适应性(图3)。在优化条件下尝试合成了10个不同取代衍生物,探讨电子效应、位阻效应在取代过程中产物产率的影响。
比较同一种底物与不同溴代烷烃反应时,乙基-1H-吡唑并[3,4-b],1-环丙基-1H-吡唑并[3,4-b],1-环丁基-1H-吡唑并[3,4-b]吡啶,1-环戊基-1H-吡唑并[3,4-b]吡啶,1-苄基-1H-吡唑并[3,4-b]吡啶,产率分别是94.4%、93.2%、92.5%、92.1%、92.2%。表明由于取代基空间位阻不同,产物产率有所影响;比较不同底物乙基-1H-吡唑并[3,4-b]吡啶、1-乙基-1H-吡咯并[2,3-b]吡啶产率分别是94.4%、93.1%,由于吸电子效应,使得1H-吡唑并[3,4-b]吡啶N-H更容易脱去,产率有所提高(表5)。从实验数据可以看出1H-吡唑[3,4-b]并吡啶及其衍生物与不同的取代基均可以在优化条件下顺利进行,均可以取得较高的产率。
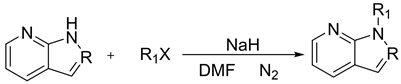
Figure3. Reactive substrate extended synthetic routes
图3. 反应底物扩展合成路线

Table 5. Reaction substrate expansion
表5. 反应底物扩展
3.3. 可能的反应机理
根据相关文献,反应底物在强碱性条件下脱去H+,使共轭体系带负电,进而进攻C-Br键,形成目标产物(图4)。
4. 结论
本文报道了1H-吡唑[3,4-b]并吡啶及其衍生物与溴乙烷等基团的亲核取代反应,并对该反应合成条件进行优化。实验结果显示,以低于10 mol% DMAP为催化剂,以DMF作为溶剂,N2保护下,反应体系在0℃进行脱H 30 min,25℃进行取代30 min的条件下,可以顺利地发生反应,获得目标产物1-乙基-1H-吡唑并[3,4-b]吡啶及其衍生物1-乙基-1H-吡咯并[3,4-b]吡啶,分离产率最高可达94%。在此条件下,探索了不同取代基适应性,实验表明该优化条件下1H-吡唑[3,4-b]并吡啶及其衍生物可与多种取代基进行取代反应,反应产率稳定在91%~94%之间。
基金项目
国家自然科学基金(82073608);河北省自然科学基金(B2019209330);华北理工大学校内立项科技项目(28414899)资助。
NOTES
*通讯作者。