1. 引言
1.1. 癌症及检测技术
癌症是21世纪以来对人类身体健康危害最大的疾病之一,全世界每年大概有1000万人死于癌症 [1] 。当前的医疗技术对癌症的治疗还有待提高,特别是对癌症早期患者来说,如果能及时发现并采取治疗干预的话,就是治疗癌症的最佳时期。因此,及时和准确的癌症早期诊断与癌症患者的生存率相关。快速又准确的癌症检测技术对于全人类解决癌症现有问题具有非常重要的意义,也值得化学、材料、生物、医学等相关领域的研究员进行深入地科学研究。
目前追踪癌症演变或治疗反应的方法包括基于程序的、基于成像的和基于组织活检的技术 [2] 。基于程序的癌症检测,如筛查结肠镜检查结肠癌或内窥镜检查食管癌 [3] ,在癌症检测中是有效的,但属于资源密集型,需要专门的人员和设备,而且这种检查对于患者来说是痛苦的。基于成像的癌症检测,比如磁共振成像、正电子发射断层扫描和超声检查是非侵入性的、可重复的检测方式,可以比较方便地用于筛查、监测和评估治疗反应。然而,成像设备的性能差异很大,对设备要求高,部分具有放射性伤害、小病发现难的问题,而且许多成像方式价格昂贵,在资源匮乏的环境中不能广泛使用,因此限制了它们作为指导临床癌症检测的通用方法 [4] 。基于组织活检的技术目前是诊断和评估肿瘤遗传、蛋白质组学或转录组学数据的金标准,但它侵入性强,代表性不全且具有一定的滞后性,可能出现假阴性的情况 [5] 。因此,开发能够克服这些局限的癌症检测方式成为了关键性的需求。
近些年来,科学家们发现了一种新型检测技术——液体活检。液体活检是一种微创方法,用于检测体液中具有预后或诊断作用的肿瘤衍生标志物 [6] ,具有早期诊断、转移跟踪、耐药性预测、预后复发监测等特点。同时,它是非侵入性的、价格低廉的、低风险的、反映综合信息的,可以避免传统检测方式所带来的局限性。
液体活检是指对人的体液中的生物标志物进行分析进而反映相关信息的活体检测 [7] 。目前它的检测内容主要包括循环肿瘤细胞、循环肿瘤DNA和外泌体。与循环肿瘤DNA或循环肿瘤细胞外泌体相比,CTC是结构完整的细胞,还蕴含着很多肿瘤患者的遗传物质。CTC可以全面而且系统地反映整个肿瘤液体活检的发展过程,所以在癌症诊断和监测中作为液体活检的分子储存库显示出了很大的应用前景。
循环肿瘤细胞(circulating tumor cell, CTC)是从实体肿瘤病变中脱落并进入血液的癌细胞 [8] ,作为种子可能扩散到远处的部位并引起新的转移性病变。
循环肿瘤细胞于1869年被发现并首次报道 [9] ,该研究在肿瘤循环细胞领域有着非常重要的影响。CTC水平与多种部位的肿瘤的不良预后相关,包括结直肠癌、乳腺癌和前列腺癌等。虽然CTC是近几十年来研究最深入的癌症循环肿瘤细胞,发表了很多篇论文,但是有关CTC的研究仍存在着很多挑战。第一,循环中很少有CTC,通常每10毫升癌症患者的血液中才发现0到10个癌细胞 [10] 。特别是在肿瘤的前期阶段,CTC无法成为可靠的早期肿瘤生物标志物。第二,由于CTC的异质性 [11] ,检测效率也会受到影响。由于这些限制,所以需要发展更多高效的CTC富集方法。
因此,与循环肿瘤DNA或循环肿瘤细胞外泌体相比,CTC是结构完整的细胞,还蕴含着很多肿瘤患者的遗传物质。CTC可以全面而且系统地反映整个肿瘤液体活检的发展过程,所以在癌症诊断和监测中作为液体活检的分子储存库显示出了很大的应用前景。
1.2. 循环肿瘤细胞检测方法简介
1.2.1. 传统的循环肿瘤细胞检测方法
CellSearch®系统是首个通过美国食品和药物监督管理局(FDA)的批准进入临床应用的CTC检测系统,能够用于多种癌症的疗效监测和预后评估,可以为转移性结直肠癌、乳腺癌和前列腺癌患者的预后提供信息 [12] 。虽然CellSearch®获得了FDA的批准,但该平台对上皮标志物的依赖和对免疫抗原表达细胞的排除未能捕捉到具有预后价值的重要亚群 [13] [14] 。而且由于CellSearch®系统的低敏性,它几乎只能用于晚期癌症检测,因为它不能有效地检测癌症的早期和中期进展。由于这些局限性,因此需要发展特异性高、纯度高和细胞活性高的CTC分离技术。
1.2.2. 基于微流控芯片的循环肿瘤细胞检测方法
1) 基于物理性质差异的循环肿瘤细胞分离方法
循环肿瘤细胞可以通过物理性质的差异,比如大小、密度、可变形性、介电性、流体力学、介电电泳等方面从癌症患者的血液中有效地分离出来。
a) 大小和可变形性
基于细胞大小差异筛选出CTC是很早以前就使用的分离方法之一,这种技术方法相对来说比较简单而且成本比较低 [15] 。根据有关文献报道,CTC的粒径大小为13~25 µm [16] ,而血细胞的尺寸则比较小,红细胞的粒径为5~9 µm [17] ,白细胞的粒径为8~11 µm [18] 。
G.E. Hvichia等报道了一种基于CTC的大小和变形性来实现CTC的富集,并自动染色用于细胞识别,随后从这种微流控芯片出口中回收细胞的微流控芯片 [19] 。使用这种微流控芯片,平均细胞捕获效率为42%至70%。最重要的是,使用这种微流控芯片处理患者的样本后回收的CTC存活率高,并且仍然可以用于下游分子分析。
b) 流体动力学
据文献报道,通过微流控技术分离循环肿瘤细胞CTC是一种比较高效的方法,主要是将微流控技术与流体力学相结合 [20] 。当流体在微通道中流动时,流体中的悬浮细胞与微流控芯片内部发生碰撞,产生一定的作用力,不同尺寸的细胞就会产生不一样的流动轨迹,所以循环肿瘤细胞CTC就可以与血细胞分离。
基于确定性侧向位移芯片(DLD)的分离是一种根据细胞大小和流体动力学结合将CTC和血细胞分离的技术方法 [21] 。Kevin Loutherback等提出了一种mL/min流速的微流控液滴芯片 [22] ,使用确定性横向位移阵列从癌症患者的血液中连续捕获存活的CTC。这种微流控芯片的一个独特之处是芯片内部凸点阵列使用的是三棱柱桩而不是圆柱桩。与圆柱桩相比,三棱柱桩有更高的吞吐量,并且可以减少样本堵塞微流控芯片通道的概率。根据DLD的原理,超过设计临界尺寸的大颗粒(如癌细胞)将沿着阵列的倾斜轴流动,而流体和小颗粒将沿着阵列的水平方向流动。使用这种微流控芯片可以在几分钟内从几毫升的临床血液样本中分离出85%以上的CTC,而且不影响细胞活力,以便对细胞进行下一步的培养和分析。
c) 介电电泳
不同细胞因为它们的性质不同,比如直径、膜电容、胞质电导率等不同的物理性质 [23] ,具有不一样的介电参数。介电电泳是一种用于细胞与其他分子或者细胞与细胞之间的分离方法。不同性质的细胞在同样的电场作用下产生不同的介电力,由于循环肿瘤细胞CTC与血细胞不一样,所以可以通过介电电泳方法用于CTC与血细胞的分离。
Jen等研究设计了一种通过继电器在相邻电极对之间切换电场进而产生步进电场的圆形微电极的微流控芯片 [24] ,可以有效地从外周血样本中分离宫颈癌细胞(HeLa)。HeLa细胞和红细胞都随机分布在底物上,当施加向外的步进电场时,HeLa细胞和红细胞都被推到最外层的电极上;当施加向内的步进电场时,HeLa细胞向中心电极的运动速度比红细胞快。最后,HeLa细胞被集中到中央微电极上,并从血液样本中分离出来。实验结果证明了从血液样本中分离HeLa细胞的可行性。
2) 基于亲和性的循环肿瘤细胞分离方法
在使用微流控技术分离循环肿瘤细胞中比较常见的方法是基于抗体或适配体等亲和性的分离。这种方法主要是利用靶标与配体的识别,进而达到捕获CTC的目的。抗体和适配体是经常使用的配体,它们能够被修饰在微流控芯片的内部结构当中,与循环肿瘤细胞CTC表面的特异性标志物形成非共价键 [25] [26] ,进而CTC被捕获于微流控芯片当中,而其他细胞则随缓冲液流出。
a) 抗体识别
在分离循环肿瘤细胞CTC的技术方法中,基于抗体亲和性的分离方法是CTC分离最常见的方法之一。上皮细胞黏附分子(EpCAM)在上皮细胞癌变的过程中起作用,是区分CTC与血细胞重要的生物标志物。通过将EpCAM抗体修饰在微流控芯片的内部结构中,当样本通入微流控芯片内部时,EpCAM抗体会特异性地识别出目标CTC,并与靶标形成非共价键,进而CTC被捕获于微流控芯片当中,其他细胞则随缓冲液流出。
Metages Gashaw Ahmed等描述了一种新的微流控芯片(SDI-Chip) [27] ,用于高效率、高特异性的CTC捕获和检测。SDI-Chip由修饰EpCAM抗体的涂层微柱阵列排列组成,中间有一个样品入口,两边各有一个缓冲液的入口。SDI-Chip选择性地增强了CTC与抗体涂层微柱阵列的相互作用,从而高效地捕获CTC,同时也减少了血细胞与抗体涂层微柱阵列的非特异性相互作用。最后,从癌症患者的血液样本中捕获CTC的效率大于92%,纯度为82%。
b) 核酸适配体识别
虽然抗体可以特异性地识别出目标CTC的靶标,但是其成本比较高。核酸适配体作为抗体的平价代替物,也可以实现循环肿瘤细胞CTC的分离。
核酸适配体是经过体外筛选得到的一小段单链DNA或RNA,它可以与目标配体形成非共价键并特异性地结合 [28] 。核酸适配体与靶标的结合主要是通过螺旋折叠的方式与靶配体的互补序列结合,而抗体与靶标的结合主要是与目标抗原表面特异性的抗原簇结合。
Yang等开发出了一种微流控芯片(ApTDN-Chip) [29] ,使用10纳米以下的三维DNA结构作为框架,顶部修饰了一个适配体。垂直纳米框架确保了适配体处于高度有序的直立方向,更有利于微流控芯片上的适配体与样本中的CTC接触,并提高CTC的捕获效率。同时,受限四面体纳米结构支架也降低了局部过度拥挤效应。与单价适配体修饰芯片相比,由于三维DNA结构刚性框架,ApTDN-Chip的捕获效率提高了近60%。除此之外,ApTDN-Chip使DNase I更容易接近适配体,释放效率接近85%,细胞存活率达到91%,有利于下游分子的分析。
1.2.3. 基于微流控芯片的循环肿瘤细胞团分离方法
从肿瘤患者的血液中捕获的单个循环肿瘤细胞(CTC)提供了关于不同阶段疾病的有效信息 [30] ,有改善肿瘤患者临床管理的潜力 [31] 。不过除了单一的CTC外,在循环系统中的CTC细胞团同样具有很高的研究价值。尽管这些CTC细胞团比较少见,但是这些CTC细胞团在促进原发肿瘤的生长和转移扩散方面发挥着重要作用。它们的转移倾向估计是单一CTC的100倍,是因为它们有着较低的凋亡率和较高的延长生存属性 [32] 。因此,对CTC细胞团进行研究在肿瘤患者早期诊断、治疗效果的监控、癌症复发的监测、预后评估和提供个性化治疗等方面有着非常重要的意义。
迄今为止,CTC分离技术的敏感性和特异性主要是针对单细胞检测进行校准的,但这些技术却不适用于有效分离可行的CTC细胞团 [33] 。例如,微滤技术由于其快速和直接的操作被广泛应用于CTC分析中,但可能会破坏CTC细胞团的完整性 [34] 。另一方面,基于抗体的富集系统,由于依赖于特定的膜抗原和CTC细胞团较小的表面积–体积比会对免疫捕获效率产生负面影响 [35] ,使得它们在CTC细胞团富集时效率特别低。在这方面更有潜力的是最近专门针对CTC细胞团设计的微流控芯片,它们可以实现相对较高的灵敏度和富集捕获效率。
Mert Boya等介绍了一种新型CTC细胞团捕获井的微流控芯片(Cluster-Wells) [36] ,它结合了膜过滤的速度和实用性以及微流控芯片提供的灵敏性和确定性进行筛选。Cluster-Wells中有大于10万个微井使白细胞、红细胞和血小板畅通无阻并筛选出全血中的CTC细胞团,同时仍然保留CTC细胞团的完整性。它以大于25 mL/h的吞吐量有效地隔离了几乎所有CTC细胞团,并允许从设备中回收存活率高的CTC细胞团。使用Cluster-Wells可以从前列腺癌和卵巢癌患者的血液中分离出2到100个细胞的CTC群集,并使用RNA测序进行分析。同时,Cluster-Wells设计为一次性塑料设备,以确保快速、低成本制造,使该技术应用于各种研究和临床环境中。
虽然这些年来,科学家和研究员们对CTC细胞团的分离与富集有着不少的研究,但仍然有许多的局限性,比如特异性不高、纯度不高、细胞活性低等,因此还需要发展更多特异性高、纯度高和细胞活性高的CTC细胞团分离富集技术,以便更好地研究CTC细胞团在癌症转移中的作用,并建立其作为管理疾病的预后标志物的临床效用。
为了解决CTC细胞团分离和研究的一些局限性,参考了以往的文献报道 [19] ,我们使用一种微流控芯片来富集捕获CTC细胞团。
2. 实验结果
2.1. 实验仪器、试剂和材料(表1、表2)
2.2. 实验方法
2.2.1. 微流控芯片掩模版的设计以及制作
微流控芯片的掩膜版设计图是用AutoCAD软件绘画微流控芯片内部结构的设计图。将绘画好的AutoCAD结构图发给掩模版制作公司(深圳清溢精密光电设备有限公司),制作含有微流控芯片结构的菲林片。之后进行光刻,光刻胶选用负性胶SU-83035,实验流程为:1) 硅片旋胶与前烘;2) 硅片曝光与后烘;3) 显影;4) 坚膜与氟化。
2.2.2. 微流控芯片的制作
制作微流控芯片所需的试剂为聚二甲基硅氧烷(PDMS)与引发剂,使用光刻好的硅片作为模板来制作微流控芯片,并通过等离子体清洗机与载玻片进行键合,之后用烘箱加热使微流控芯片更加牢固。实验流程为:
1) 配胶;2) 倒模;3) 加热固化PDMS芯片;4) PDMS芯片键合。
2.2.3. 模型细胞团的培养与制备
我们首先配制CTC细胞团的培养基,取100 mL DMEM/F12 培养基,配制成终浓度为1xB27、0.4% BSA、20 ng/mL EGF、20 ng/mL bFGF、5 μg/ml胰岛素的培养基,混匀后密封保存于4℃冰箱。然后开始制备CTC细胞团,具体实验步骤如下:
1) 取适量对数生长期的CTC,用PBS清洗CTC三次,之后加入0.25%胰蛋白酶消化液,在显微镜下观察细胞的状态,待CTC变圆脱落时加入等量的完全培养基终止反应。
2) 将细胞吸到EP管中,用离心机500 rpm离心5 min,之后去除上清。
3) 加入CTC细胞团培养基重悬细胞,用移液枪充分吹打,混匀为单细胞悬浮液后,用移液枪吸取10 uL到细胞计数板中进行计数。
4) 将细胞接种于已经包被了1.2% Poly-HEMA的6孔板中,加入CTC细胞团培养基(1 mL/1 × 104个细胞),轻摇混匀后放置于37℃、5% CO2无菌恒温培养箱中培养,直至形成稳定的CTC细胞团。
2.2.4. 模型细胞团的分离与富集
对于微流控芯片的CTC细胞团的富集捕获实验,我们用无胰酶细胞消化液处理含有单个CTC和CTC细胞团的细胞悬浮液,然后离心去上清液。加入500 μL用PBS稀释的5 μM钙黄绿素,用移液枪进行吹打,使CTC和CTC细胞团均匀分散,然后放置于恒温箱中37℃孵育30分钟。之后离心去掉上清液,加入1 mL PBS,用移液枪进行吹打,使CTC和CTC细胞团均匀分散。在CTC细胞团分离富集芯片中通入BSA (胎牛血清蛋白),防止非特异性吸附,之后通入PBS。在倒置荧光显微镜下进行CTC细胞团的富集捕获实验操作,使用一次性注射器和微量注射泵将含有单个CTC和CTC细胞团的细胞悬浮液注入到微流控芯片中。将细胞悬浮液的流速调节为100 μL/h,PBS的流速调节为300 μL/h。当CTC细胞团流入芯片当中时开始计数,计数到100个细胞团后停止计数,同时收集两个出口的CTC细胞团,并进行显微镜成像和数量统计。
2.2.5. 模型细胞团的稳定性与生存能力
为了验证用微流控芯片处理后循环肿瘤细胞团的稳定性与生存能力,我们将收集好的CTC细胞团进行培养。具体实验步骤为:
1) 上层琼脂糖的配置:将1.2%琼脂糖与2 × DMEM按体积比1:1混合,并加入FBS (胎牛血清)和庆大霉素,使FBS终浓度为15%~20%,庆大霉素终浓度为5 μg/ml,混匀,然后加入到细胞培养板6孔板中。
2) 用1 mL DFP重悬离心后的细胞,取适量该细胞用DFP稀释到1 mL。
3) 下层琼脂糖的配置:将0.6%琼脂糖与2 × DMEM按体积比1:1混合,并加入庆大霉素和FBS,使FBS终浓度为20%,庆大霉素终浓度为5 μg/ml,混匀。将配好的琼脂糖加入到细胞中,充分混匀,再平分到每个6孔板中,确保平行孔内的细胞量一致。
4) 在6孔板的2个间隙中加入1 mL PBS,并加入庆大霉素,目的是为了提供潮湿的环境,防止琼脂糖龟裂。
5) 定期观察琼脂糖,定期在其表面加200 μL DFP,保持其表面湿润,在37℃、含有5% CO2的环境中进行孵育,并在12 h、24 h、36 h进行细胞团成像。
2.3. 结果与讨论
2.3.1. 实验设计原理
我们使用了一种微流控芯片来富集捕获CTC细胞团,这种微流控芯片的设计是通过利用CTC细胞团的不对称性和单个CTC的对称性来富集CTC细胞团。如图1所示,微流控芯片使用的是DLD微柱阵列,柱间间隙为63 µm,具有两个入口(一个是PBS注射入口、一个是细胞悬浮液的注射入口)、两个出口(一个是细胞团回收出口、一个是废液出口)。
CTC细胞团富集芯片的内部通道高度的上限为30 µm,这限制了细胞团在Z轴方向上排列的高度,迫使大多数CTC细胞团在X-Y平面上对齐。其次,这种芯片的柱型设计为“I”形柱,“I”形柱中的凹槽对典型的光滑流线造成干扰,从而导致不对称粒子(CTC细胞团)的偏转;而悬浮中的单个CTC细胞具有球形对称性,这些细胞保持不偏转。通过微流控芯片受限的通道高度和不对称支柱,实现利用CTC细胞团的不对称性和单个CTC的对称性来富集CTC细胞团。

Figure 1. Schematic diagram of the movement trajectory of CTC clusters and single CTC
图1. CTC细胞团和单个CTC的运动轨迹原理图
2.3.2. 模型细胞团的分离与富集
我们首先将含有CTC细胞团的细胞悬浮液添加到全血中,然后注入CTC细胞团富集捕获微流控芯片中,观察CTC细胞团跟血细胞(单个细胞)的运动轨迹并进行显微镜成像。从图2可以看出,红细胞与CTC细胞团有不同的运动轨迹,红细胞保持不偏转,而CTC细胞团被有效偏转。

Figure 2. Microscopic imaging of the movement of CTC clusters and blood cells
图2. CTC细胞团和血细胞的运动轨迹显微成像图
将含有单个CTC和CTC细胞团的细胞悬浮液添加到缓冲液中,然后将这些细胞注入微流控芯片中。在倒置荧光显微镜下进行模型细胞团的分离与富集实验。实验结果如图3所示,在微流控芯片中,CTC细胞团跟单个CTC有不一样的运动轨迹(图3(A)),这表明不对称柱诱导了CTC细胞团的偏转,使它们流入不同的出口。大部分的CTC细胞团都进入了CTC细胞团回收出口,对CTC细胞团回收出口处的回收液进行明场和荧光场的显微镜成像,可以明显地看到回收液中有很多的CTC细胞团(图3(B));对废液回收出口处的回收液进行明场和荧光场的显微镜成像,可以明显地看到回收液中有很多的单个CTC (图3(C))。对于在缓冲液中运行的CTC细胞团,我们做了三次平行实验,通过统计发现在CTC细胞团回收出口收集的CTC细胞团的比例分别为71%、68%和75% (图3(D))。



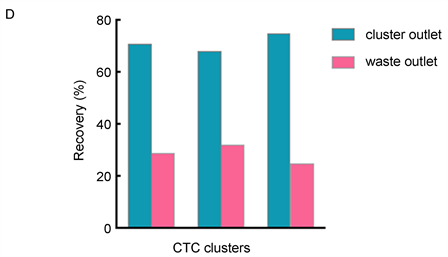
Figure 3. Separation and enrichment of model CTC clusters: (A) motion trajectories of CTC clusters and CTC; (B) microscopic imaging of bright and fluorescent fields at the CTC cluster recovery exit; (C) microscopic imaging of bright and fluorescent fields at the waste exit; (D) histograms of statistical proportions of CTC clusters at the CTC cluster recovery exit and the waste exit
图3. 模型细胞团的分离与富集:(A) CTC细胞团和CTC的运动轨迹;(B) CTC细胞团回收出口处明场和荧光场的显微镜成像;(C) 废液出口处明场和荧光场的显微镜成像;(D) CTC细胞团回收出口和废液出口的CTC细胞团的统计比例柱状图
2.3.3. 富集的模型细胞团的活性鉴定
为了验证经过微流控芯片处理之后是否影响CTC细胞团的活性以及增殖能力,我们收集了CTC细胞团回收出口的细胞团进行培养。如图4所示,细胞团在培养后的12 h、24 h、36 h数量逐渐增加,所占的体积也越来越大,因此在显微镜下的成像也越来越明显。这表明微流控芯片上的处理对CTC细胞团的活力没有影响,并不影响它们的增殖能力。因此,这种CTC细胞团捕获微流控芯片是分离CTC细胞团的有效工具。

Figure 4. Microscopic imaging of enriched model CTC clusters before and after culture
图4. 富集的模型细胞团培养前与培养后的显微镜成像
3. 总结
我们使用了一种CTC细胞团富集微流控芯片来富集捕获CTC细胞团,它依赖于CTC细胞团的不对称性,可以用于有效地将CTC细胞团与CTC区分开来,从而达到富集CTC细胞团的效果。对于在全血中的血细胞与CTC细胞团,在微流控芯片中进行分离,红细胞与CTC细胞团有不同的运动轨迹。对于在缓冲液中的CTC细胞团与CTC,我们做了三次平行实验,在微流控芯片CTC细胞团回收出口收集的CTC细胞团的比例分别为71%、68%和75%,并且CTC细胞团在培养后的12 h、24 h、36 h数量逐渐增加,在显微镜下的成像也越来越明显。这表明微流控芯片上的处理对CTC细胞团的活力没有影响,并不影响它们的增殖能力。因此这种CTC细胞团富集捕获微流控芯片将进一步使CTC细胞团的研究和临床应用成为可能。
NOTES
*通讯作者。